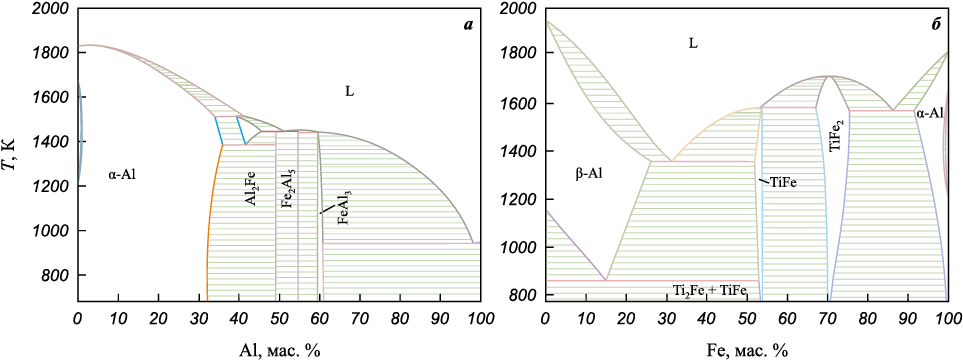Перейти к:
Спекание и термокинетическое моделирование эволюции состава термитных смесей в условиях регулируемого нагрева
https://doi.org/10.17073/1997-308X-2025-5-5-16
Аннотация
Проанализировано поведение прессовок из смесей порошков металлов (Al, Ti) и переработанных отходов металлообработки (Fe + Fe2O3 + C) в условиях вакуумного спекания при регулируемом нагреве для исследования возможности получения in situ металломатричных композиционных материалов с упрочняющими оксидными частицами. В качестве исходных материалов использованы порошки титана и алюминия с фракциями d < 160 мкм и <100 мкм соответственно, а также порошок переработанной стружки из стали размером менее 300 мкм. В результате проведенного эксперимента обнаружен неоднородный фазовый состав образцов, который исследовали с помощью рентгеновского дифрактометра XRD-6000 с CuKα-излучением и оптического микроскопа «Axiovert 200MAT». Продемонстрировано существенное различие в поведении систем на основе алюминия и титана: первая система характеризуется ярко выраженным термическим пиком, а во второй – превращения идут в спокойном режиме. Предложена термокинетическая модель процесса, учитывающая стадийность превращений для обеих систем. Учтены металлотермические реакции и реакции образования интерметаллидов. Дана оценка формально-кинетическим параметрам реакций с помощью полуэмпирического подхода. Полученные параметры корректировались при сравнении с экспериментом. Модель реализована численно с помощью полунеявного метода Эйлера. Проверялись закон сохранения массы и неизменность числа атомов. Начальный состав образцов в расчетах варьировался (за счет учета присутствия кислорода, углерода и соотношения железа и оксида железа в стружке) таким образом, чтобы в результате синтеза получить состав продуктов, максимально приближенный к результатам эксперимента. Получено качественное соответствие теории и эксперимента.
Ключевые слова
Для цитирования:
Князева А.Г., Коростелева Е.Н., Сафронова В.С. Спекание и термокинетическое моделирование эволюции состава термитных смесей в условиях регулируемого нагрева. Известия вузов. Порошковая металлургия и функциональные покрытия. 2025;19(5):5-16. https://doi.org/10.17073/1997-308X-2025-5-5-16
For citation:
Knyazeva А.G., Korosteleva Е.N., Safronova V.S. Sintering and thermokinetic modeling of the phase evolution in thermite powder mixtures under controlled heating. Powder Metallurgy аnd Functional Coatings (Izvestiya Vuzov. Poroshkovaya Metallurgiya i Funktsional'nye Pokrytiya). 2025;19(5):5-16. https://doi.org/10.17073/1997-308X-2025-5-5-16
Введение
Синтез композитов с формированием упрочняющих частиц in situ привлекает внимание в порошковых технологиях в связи с разными приложениями для аэрокосмической, автомобильной и энергетической отраслей промышленности, что вызывает большой интерес со стороны различных групп исследователей [1–4]. Спектр возможных порошковых металломатричных композитов весьма широк как по составу матрицы, так и по набору упрочняющих фаз. Среди них особый интерес представляют композиции с химически взаимодействующими порошковыми компонентами, реакции между которыми приводят к синтезу упрочняющих фаз in situ в виде микровключений. В значительной степени это относится к синтезу горением с использованием металлотермических реакций [5–9]. Реакции этого типа, как правило, сопровождаются значительным тепловым эффектом, что способствует поддержанию процесса синтеза. Формирование упрочняющих частиц непосредственно при создании композитов благоприятно с точки зрения образования хороших контактов между частицами и окружением. Однако наличие в смеси, в которой возможна реакция восстановления одного металла другим, иных компонентов может существенно изменить пути реакций вследствие различных условий взаимодействия в разных локальных объемах [10].
Задача становится более неоднозначной, если один из компонентов порошковой смеси представляет собой сложную композицию металлической основы с оксидными включениями, которая была получена в результате переработки стальной стружки [11].
В настоящей работе исследуется возможность получения металломатричных композитов из смесей порошков Al–Fe2O3–Fe и Ti–Fe2O3–Fe (возможно, содержащих углерод) в условиях спекания в вакуумной камере в сочетании с теоретическим описанием на основе модели, учитывающей кинетику основных реакций.
1. Эксперимент
1.1. Материалы и методы
Реальное фазообразование в условиях вакуумного спекания с регулируемым нагревом при температуре спекания 1173–1473 K с выдержкой 60 мин в порошковых материалах на основе Ti–Al–Fe2O3/(Fe + C) было исследовано на примере следующих порошковых композиций (из нескольких вариантов сочетания компонентов): Al + (Fe + Fe2O3 + С) и Ti + (Fe + Fe2O3 + С). Для приготовления смесей применяли порошки титана ТПП-8 (основная фракция d < 160 мкм) и алюминия ПА-4 (d < 100 мкм). Как аналог композиции Fe + Fe2O3 + С был использован порошок переработанной стружки из стали 45 размером не более 300 мкм, характеристики которого детально описаны в работе [11]. Соотношение компонентов в смесях было рассчитано таким образом, чтобы его было достаточно как для реакции восстановления (металлотермии), так и для реакции образования интерметаллидов. Количественный состав исследуемых порошковых смесей представлен в табл. 1.
Таблица 1. Состав исследуемых порошковых смесей, мас. %
|
Выбор пропорций для составов с алюминием связан с диаграммой состояния двойной системы Al‒Fe. Первый вариант соответствует области α-AlFe3 , второй – преимущественной области фазы на основе Al3Fe и AlFe. Оба варианта предполагают экзотермические реакции.
Состав с титаном включал 75 % Ti и 25 % стружки, что обусловливает формирование матричной основы будущего композита в виде твердого раствора железа и кислорода в титане.
Структурные исследования были проведены с помощью оптической и растровой электронной микроскопии, а также рентгенофазового анализа (РФА). Были использованы оптический микроскоп «Axiovert 200MAT» (Carl Zeiss, Германия), сканирующий электронный микроскоп «Mira 3LMU» (Tescan, Чехия), рентгеновские дифрактометры XRD-600 (Shimadzu, Япония) и ДРОН-8 (Россия) с CuKα-излучением. Анализ фазового состава проведен с применением баз данных PDF 4+, а также программы полнопрофильного анализа POWDER CELL 2.4.
Согласно исследованиям [11], окисленная в воде стружка после измельчения представляет собой набор фрагментов-частиц с железной сердцевиной, где растворен углерод (предположительно ~1,5 мас. %). Несмотря на то, что, по данным РФА, стружки карбидных фаз не было обнаружено, наличие углерода в частицах стальной стружки отмечается по результатам энергодисперсионного микроанализа. Оценка содержания углерода с использованием анализатора газовых примесей LECO ONH-836 (США) показала широкий его разброс (от 0,8 до 1,6 мас. %) за счет значительной неоднородности фрагментов обработанной стальной стружки. На поверхности этих частиц расположены обширные области оксидов железа Fe3O4/Fe2O3/FeO [11], количество которых может достигать 50–70 %. Оксидные слои локализуются неравномерно (рис. 1), поэтому взаимодействие частицы стружки с порошинками алюминия или титана будет определяться тем, с какой ее локальной областью или стороной они контактируют. В таких смесях одновременно будут контакты со вторым компонентом и чистого железа (углеродистой стали), и его оксида.
Рис. 1. Микроструктура переработанной стружки из стали 45 |
1.2. Результаты экспериментальных исследований
В результате проведенного эксперимента в условиях вакуумного спекания при Ts = 1273 К в композициях Al + (Fe + Fe2O3 + С) обеих пропорций обнаружен сложный фазовый состав [12]. Предварительно спрессованные образцы из смеси порошков алюминия и измельченной окисленной стружки теряли свою форму и разлетались на отдельные фрагменты. Выбранные условия спекания были достаточны для инициирования комплекса реакций, в результате которых в продукте были сформированы интерметаллиды группы Fe–Al и оксидные частицы. В составе продукта обнаружено остаточное (непрореагировавшее) железо (рис. 2). Кислород практически в полном объеме мигрировал из оксидов железа в алюминий с образованием Al2O3 . Бόльшую часть объема продукта занимал FeAl.
Рис. 2. Микроструктура фрагмента спеченного материала |
При увеличении содержания алюминия в прессовке в продуктах взаимодействия зафиксировано значительное количество остаточных непрореагировавших компонентов, что связано с уменьшением суммарного теплового эффекта реакций.
Второй состав – Ti + (Fe + Fe2O3 + С) – является менее экзотермичным. Так как растворимость железа в β-титане достигает максимального значения 22 ат. % при Ts = 1358 К и снижается до 0,34 ат. % в α-титане при уменьшении температуры до 673 К, предполагалось, что часть железа будет взаимодействовать с титаном с образованием интерметаллидов. При этом ожидалось, что титана будет достаточно и для взаимодействия с оксидными включениями в порошке переработанной стружки. При экспериментальных исследованиях установлено, что порошок из переработанной стружки при взаимодействии с порошком титана в составе Ti + (Fe + Fe2O3 + С) демонстрирует хорошее спекание с преимущественным диффузионным взаимодействием с железом и миграцией кислорода из оксида железа в титановую основу. Не исключено, что присутствующий в стружке углерод способствует спекаемости данной композиции за счет своей диффузии в титан. Поскольку его количество незначительно, то карбид титана не формируется в том количестве, которое можно зарегистрировать методом РФА. Взаимодействие свободного железа с титаном в присутствии оксидных включений не препятствует диффузии компонентов. В зависимости от температуры спекания возможен разный набор фаз и их количество, но во всех случаях преимущественно формируется твердый раствор на основе титана (рис. 3). При низких температурах в продуктах обнаружены нестехиометрический оксид на основе TiO2 (18 мас. %) и остатки оксида железа Fe2O3 (32 мас. %), входящего в состав частиц стальной стружки. Железо из этих частиц взаимодействует с титаном, что приводит к образованию до 20 мас. % эквиатомного интерметаллида TiFe. При более высокой температуре спекания (1473 К) непрореагировавших компонентов уже не остается и формируются два вида твердых растворов на основе α-Ti с разной концентрацией растворенных в нем железа и кислорода; там же обнаруживаются небольшие включения Ti2Fe, TiFe2 или TiFe. В качестве отдельной фазы оксиды не фиксируются (см. рис. 3).
Рис. 3. Микроструктура спеченных прессовок |
Полученные в работах [13; 14] данные послужили основой для построения термокинетических моделей, учитывающих стадийность фазообразования.
2. Модель спекания с детальной кинетикой
2.1. Баланс тепла
В термокинетической модели учитывается изменение температуры образца вследствие регулируемого внешнего нагрева и тепловыделения вследствие химических реакций. Предполагается, что вследствие малости размеров образца распределением температуры по объему прессовки можно пренебречь. Оценки, подтверждающие такую возможность, даны в работе [15]. Уравнение баланса тепла имеет вид
| \[Vc\rho \frac{{dT}}{{dt}} = V{W_{ch}} + \sigma \varepsilon S\left( {T_W^4 - {T^4}} \right) - \alpha S\left( {T - {T_e}} \right),\] | (1) |
где T – температура; t – время; V и S – объем и площадь поверхности прессовки; с и ρ – теплоемкость и плотность спрессованной смеси порошков; Wch – суммарное химическое тепловыделение; σ – постоянная Стефана–Больцмана; ε – степень черноты поверхности прессовки; α – коэффициент теплообмена (в вакууме можно принять равным нулю); Те – температура окружающей среды (если необходимо учитывать теплообмен по закону Ньютона).
Температура стенок вакуумной камеры TW изменяется по линейному закону:
TW = T0 + at, если T < Ts , и TW = Ts , если T ≥ Ts , | (2) |
где а – скорость нагрева; Ts – температура спекания.
Полагаем, что в интервале температур Tmin–Tmax имеет место плавление, при котором доля жидкой фазы (ηL ) изменяется от 0 до 1:
| \[\begin{array}{c}{{\rm{\eta }}_{\rm{L}}} = {\rm{0 }\rm{ } \rm{при}\rm{ }}T \le {T_{\min }},\\{{\rm{\eta }}_{\rm{L}}} = {\left( {\frac{{T - {T_{\min }}}}{{{T_{\max }} - {T_{\min }}}}} \right)^2}{\rm{ }\rm{ } \rm{при}\rm{ }}{T_{\min }} < T \le {T_{\max }},\\{{\rm{\eta }}_{\rm{L}}} = {\rm{1}\rm{ } \rm{при}\rm{ }}T > {T_{\max }}.\end{array}\] | (3) |
В нашем случае Tmin соответствует минимальной из температур плавления реагентов и продуктов реакций, а Tmax – максимальной из температур плавления (табл. 2) выбранной системы.
Таблица 2. Температуры плавления исходных веществ и некоторых продуктов
| |||||||||||||||||||||||||||||||||||
Изменение теплоемкости в интервале температур плавления соответствует закону
| \[c = \left( {{c_{\rm{S}}} + \frac{{{Q_{{\rm{eff}}}}}}{m}\frac{{\partial \eta }}{{\partial T}}} \right)\left( {1 - {\eta _{\rm{L}}}} \right) + {c_{\rm{L}}}{\eta _{\rm{L}}},\] | (4) |
где сS – теплоемкость смеси в твердой фазе, cL – теплоемкость смеси в жидкой фазе; Qeff – эффективная скрытая теплота плавления, Дж/моль; m – средняя молярная масса смеси реагентов и продуктов реакций.
Тепловыделение химических реакций находим по формуле
| \[{W_{{\rm{ch}}}} = \sum\limits_{i = 1}^n {{Q_i}{\Phi _i}} ,\] | (5) |
где n – количество реакций; Φi – скорости реакций; Qi – тепловые эффекты реакций.
2.2. Модель эволюции фазового состава
в процессе спекания
Поскольку детальный механизм большинства реакций с участием твердых веществ, как правило, неизвестен и стадиями реакций являются разнообразные физические процессы, то наиболее корректными оказываются модели с редуцированными химическими стадиями, которые учитывают формирование наблюдаемых в эксперименте фаз.
В системе с алюминием (который в этой системе имеет самую низкую температуру плавления) ожидается, что основной экзотермической реакцией будет реакция восстановления железа из оксида алюминием:
| 2Al + Fe2O3 = Al2O3 + 2Fe. | (I) |
Восстановленное железо далее реагирует с избыточным алюминием с образованием интерметаллидных фаз. Поскольку основные реакции осуществляются с высоким тепловым эффектом, то собственно процесс фазообразования должен протекать преимущественно в жидкой фазе и сопровождаться появлением спеков [16]. Однако, в соответствии с [17], непосредственно взаимодействию алюминия и оксида железа в процессе горения предшествуют стадии частичного разложения Fe2O3 → Fe3O4 → FeO. Авторами [17] обнаружены тонкие пластинки оксида FeAl2O4 , получающиеся в результате взаимодействия FeO c аморфной пленкой Al2O3 , всегда присутствующей на алюминии:
| FeO + Al2O3 → FeAl2O4 . | (II) |
Заметим, что оксиды FeAl2O и FeAl2O4 часто образуются в системе Al–Fe2O3 , что неблагоприятно для восстановления оксида железа, особенно в присутствии оксида Al2O3 [18].
При взаимодействии Al и Fe2O3 нельзя исключать и стадию
| 2Fe2O3 → 4FeO + O2 | (III) |
с последующим окислением алюминия:
| 4Al + 3O2 = 2Al2O3 . | (IV) |
На диаграмме состояния Al–Fe имеется несколько интерметаллидных фаз (рис. 4). Диаграмма состояния была построена в открытой версии программного пакета Thermo-Calc Software на основе базы данных TCBIN: TC Binary Solutions v1.1.
Рис. 4. Диаграммы состояния Al–Fe (а) и Ti–Fe (б) |
Образование интерметаллидных фаз соответствует реакциям
| Al + Fe = FeAl, | (V) |
| FeAl + Al = FeAl2 , | (VI) |
| FeAl + 2Fe = Fe3Al, | (VII) |
| FeAl2 + Al = FeAl3 , | (VIII) |
| FeAl2 + FeAl3 = Fe2Al5 . | (IX) |
Интерметаллид AlFe на диаграмме не указан, однако известно, что он образуется в результате упорядочения α-Fe. Fe3Al является метастабильным соединением, который появляется в результате фазового превращения второго порядка из FeAl [19]. Присутствующий в обработанной стружке углерод мог бы участвовать в синтезе карбида алюминия (Al4C3 ), но режим спекания и состав порошковой композиции не могут обеспечить требуемое количество углерода и температурные условия, необходимые для инициирования соответствующей реакции.
Во втором случае (система Ti–Fe2O3–Fe–C) наиболее легкоплавким является железо (см. табл. 2). Авторы [20] утверждают, что термитная реакция Ti–Fe2O3 включает несколько стадий – таких, как восстановление Fe2O3 под действием Ti с образованием фаз Fe и TiO2 , а затем формирование интерметаллической метастабильной фазы Ti2Fe. C учетом частичного разложения оксида железа, присутствия в смеси углерода и образования интерметаллидных фаз (рис. 4, б) система реакций примет следующий вид:
| 3Ti + 2Fe2O3 = 3TiO2 + 4Fe, | (I′) |
| Ti + Fe = TiFe, | (II′) |
| TiFe + Ti = Ti2Fe, | (III′) |
| TiFe + Fe = TiFe2 , | (IV′) |
| Ti + C = TiC, | (V′) |
| 2Fe2O3 → 4FeO + O2 , | (VI′) |
| Ti + O2 = TiO2 , | (VII′) |
| TiO2 + Ti2Fe = Ti3FeO2 . | (VIII′) |
Обозначения концентраций (Сk ) веществ для каждой системы представлены в табл. 3 и 4.
Таблица 3. Обозначения концентраций для системы Al + (Fe + Fe2O3 )
Таблица 4. Обозначения концентраций для системы Ti + (Fe2O3 + Fe + C)
|
Для каждой системы реакций можно записать кинетические уравнения вида
| \[\frac{{d{C_k}}}{{dt}} = \sum\limits_{k = 1}^r {{\nu _{ki}}{\Phi _i}} ,\] | (6) |
где νki – стехиометрические коэффициенты компонента k в реакции i; r – число реакций, Фi – скорости реакций. Далее полагаем, что скорости реакций зависят от температуры по закону Аррениуса, а от концентраций – в соответствии с законом действующих масс:
| \[{\Phi _i} = {k_i}(T)\prod\limits_k {C_k^{{n_{ki}}}} .\] | (7) |
Здесь nki – показатели степени, равные по абсолютной величине соответствующим стехиометрическим коэффициентам;
| \[{k_i} = {k_{i0}}\exp \left( { - \frac{{{E_i}}}{{RT}}} \right),\] | (8) |
где ki0 – предэкспоненциальные факторы; Ei – энергии активации реакций; R – универсальная газовая постоянная. Для всех реакций выражения для скоростей представлены в табл. 5.
Таблица 5. Скорости реакций
|
Таким образом, для первой системы нам требуется 27 формально-кинетических параметров ki0 , Ei , Qi , а для второй – 24. Воспользоваться имеющимися данными по параметрам суммарных реакций для смесей, типичных для СВС [21], не представляется возможным. Одна из причин – существенная зависимость параметров от способа определения, вида обработки смеси, скорости нагрева и т.д. Другая причина – отсутствие данных для большинства стадий. Даже для одной из самых исследованных термитных смесей (Al–Fe2O3 ) данные разных авторов противоречивы [22], включая энтальпии реакций. Например, для реакции (VI) в системе с алюминием из [23] имеем: ΔH = –851,4 кДж/моль, а из [16] следует ΔH ≈ –752 кДж/моль.
Энтропии и энтальпии реакций находили с помощью закона Гесса:
| \[\Delta H_{298}^0 = \sum\limits_{{\rm{products}}} {{\nu _{ki}}\Delta H_{298}^0} - \sum\limits_{{\rm{reagents}}} {{\nu _{ki}}\Delta H_{298}^0} ,\] | (9) |
| \[\Delta S_{298}^0 = \sum\limits_{{\rm{products}}} {{\nu _{ki}}\Delta S_{298}^0} - \sum\limits_{{\rm{reagents}}} {{\nu _{ki}}\Delta S_{298}^0} ,\] | (10) |
где первые слагаемые в правых частях уравнений являются суммой параметров продуктов реакции, а вторые – суммой параметров исходных соединений. Однако не для всех соединений есть значения этих величин в литературе. По этой причине для предварительной оценки формальных параметров (табл. 6) использовались приближенные полуэмпирические методы. Методика оценки параметров подробнее изложена в работе [15].
Таблица 6. Формально-кинетические параметры,
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Задача для каждой системы (которая включала 10 и 9 обыкновенных дифференциальных уравнений вида (6) для систем с алюминием и титаном соответственно и уравнение баланса тепла (1)) решена численно с использованием полунеявного метода Эйлера. В каждом расчете проверялся закон сохранения массы и закон сохранения числа атомов. Расчет проводился при постоянных значениях \(\Delta S_{298}^0\) и \(\Delta H_{298}^0\). Данные по порядкам реакций корректировались при численном решении. Для первой системы получено:
k01 = 1017, k02 = 1022, k03 = 3·1022, k04 = 1022,
k05 = 1022, k06 = 8·1019, k07 = 6·1015,
k08 = 1015, k09 = 1024 с–1.
Для второй системы корректировка затронула два предэкспонента и энергию активации одной реакции:
k05 = 3·1019 с–1, k06 = 6·1023 с–1,
E6 = 150 255 Дж/моль.
Корректирующий множитель, единый для всех реакций, для системы с алюминием оказался равным 10–17, а для системы с титаном – 7,5·10–13. Критерием выбора корректирующего множителя служило характерное время протекания реакций в условиях эксперимента.
2.3. Результаты численного исследования
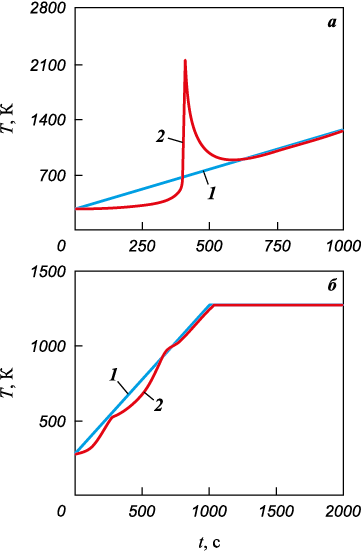
Расчет изменения температуры и состава в процессе реакционного спекания для изучаемых систем представлен на рис. 5–7. Типичные температурные кривые для смесей с алюминием и титаном различаются (рис. 5). В первом случае имеется всплеск температуры, соответствующий инициированию реакций при Т = 700÷900 К. Во втором случае ярко выраженного всплеска температуры нет, однако имеется некоторая волнистость температурной кривой.
Рис. 5. Типичное поведение температурных кривых
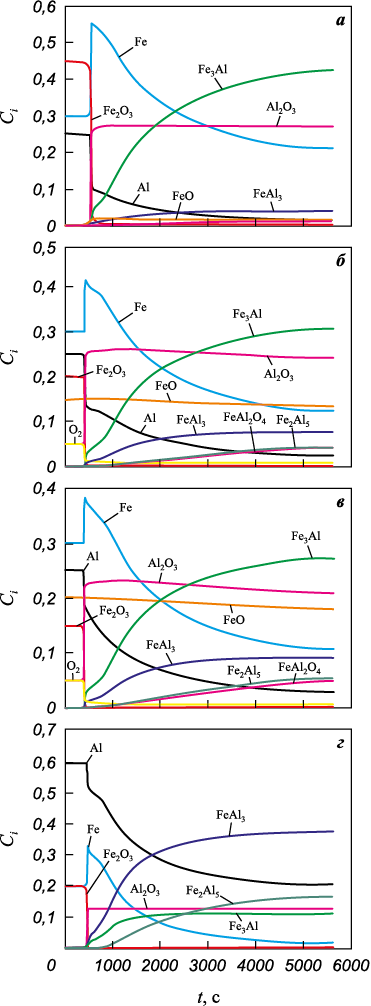
Рис. 6. Изменение фазового состава прессовки
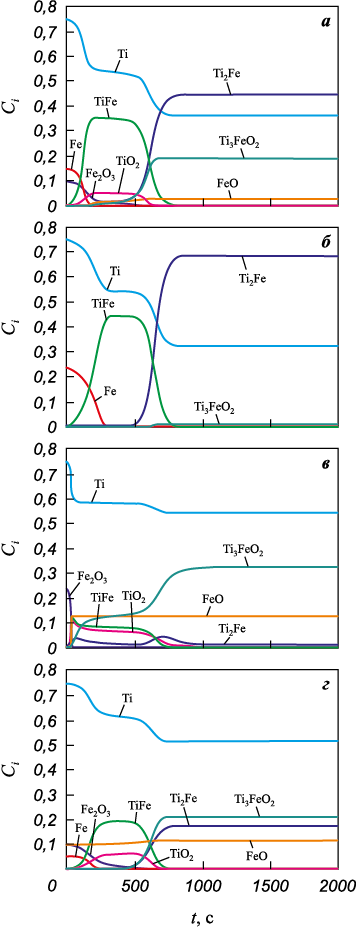
Рис. 7. Изменение фазового состава прессовки |
Как правило, такое поведение температуры связывают с чувствительностью термопары. Расчеты показывают, что это может быть обусловлено взаимовлиянием физико-химических стадий.
Заметим, что точный состав оксида железа в стружке неизвестен, что было отмечено выше. Поэтому при моделировании возможны варианты при задании начальных данных (табл. 7). Положим, что имеются оксиды двух типов – FeO и Fe2O3 . Оксид Fe3O4 в первом приближении можем рассматривать как комбинацию оксидов FeO и Fe2O3 и явно его не учитывать. Кроме того, учтем в численном эксперименте, что на поверхности частиц могут содержаться адсорбированный кислород и оксид алюминия. Только в этом случае удается получить в продуктах то количество оксида алюминия, которое наблюдается в эксперименте. Кроме того, численный эксперимент позволяет проводить исследования в широкой области изменения начального состава, что экспериментально сделать затруднительно.
Таблица 7. Начальные данные для расчетов
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
В системе с титаном таких проблем не было. Однако варьировать начальный состав порошковой смеси в численном эксперименте также возможно.
Расчеты эволюции состава для разных начальных данных представлены на рис. 6 и 7. Видим, что состав продуктов может значительно различаться. В случае системы с алюминием (см. рис. 6) в продуктах всегда присутствуют интерметаллиды Fe3Al и FeAl3 с разным процентным содержанием, а также оксид алюминия. Наиболее быстрой является реакция восстановления железа. Интерметаллид FeAl в продуктах не обнаруживается. Двойной оксид появляется в продуктах только при условии наличия в исходной смеси оксидов Al2O3 , FeO и кислорода. В последнем варианте в продуктах присутствует Fe2Al5 . Данным эксперимента более соответствует вариант 2 с содержанием кислорода и оксида в исходной смеси.
Фазовый состав прессовки с титаном также изменяется (рис. 7). Все реакции идут активно в течение интервала времени, меньшего времени спекания. Для всех составов в продуктах всегда присутствуют интерметаллид Ti2Fe и неизрасходованный титан. Фаза TiFe появляется в процессе спекания в виде промежуточного продукта. В трех вариантах продукт содержит Ti3FeO2 . Во втором варианте исходная смесь содержит малое количество оксида железа, поэтому его роль в реакциях проявляется слабо. Но оксид Fe2O3 наиболее соответствует условиям эксперимента. В условиях эксперимента продукт содержит 91 мас. % твердого раствора α-Ti + Ti2Fe и раствора α-Ti + TiFe. Оксида Fe2O3 в этом случае недостаточно для образования оксида титана. В других трех вариантах оксид TiO2 появляется как промежуточный продукт, который достаточно быстро тратится на образование двойного оксида.
Заключение
Таким образом, в представленной работе показано удовлетворительное согласие предложенной термокинетической модели с экспериментальными данными о поведении многокомпонентных порошковых смесей из стальной стружки с алюминием и титаном в условиях вакуумного спекания. Как и в эксперименте, теоретические расчеты показали значительное тепловыделение при нагреве составов Al + (Fe + Fe2O3 + C), тогда как в системе Ti + (Fe + Fe2O3 + C) процесс спекания проходит в спокойном режиме. В первом случае образование карбида алюминия в модели не учитывалось по причине низкой температуры спекания. Во втором случае карбид титана образовывался в ничтожном количестве. В экспериментах карбиды не обнаружены.
Список литературы
1. Yeh C.L., Li R.F. Formation of TiAl–Ti5Si3 and TiAl–Al2O3 in situ composites by combustion synthesis. Intermetallics. 2008;16(1):64–70. https://doi.org/10.1016/j.intermet.2007.07.016
2. Zhang X., Li X., Wang J., Liu L., Li S., Li B., Hou X., Gao J., Kariya S., Umeda J., Kondoh K., Li S. Synthesis mechanism and interface contribution towards the strengthening effect of in-situ Ti5Si3 reinforced Al matrix composites. Materials Science and Engineering: A. 2024; 918:147427. https://doi.org/10.1016/j.msea.2024.147427
3. Yang Y.F., Mu D.K., Jiang Q.C. A simple route to fabricate TiC–TiB2/Ni composite via thermal explosion reaction assisted with external pressure in air. Materials Chemistry and Physics. 2014;143(2):480–485. https://doi.org/10.1016/j.matchemphys.2013.10.003
4. Lemboub S., Boudebane S., Gotor F.J., Haouli S., Mezrag S., Bouhedja S., Hesser G., Chadli H., Chouchane T. Core-rim structure formation in TiC–Ni based cermets fabricated by a combined thermal explosion/hot-pressing process. International Journal of Refractory Metals and Hard Materials. 2018;70:84–92. https://doi.org/10.1016/j.ijrmhm.2017.09.014
5. Yeh C.L., Ke C.Y. Synthesis of TiB2–Al2O3–FeAl composites via self-sustaining combustion with Fe2O3/TiO2-based thermite mixtures. Ceramics International. 2018;44(13):16030–16034. https://doi.org/10.1016/j.ceramint.2018.06.040
6. Zhang K., Fen W., Zhu J., Wu H. Mechanical properties and microstructure of Al2O3/TiAl in situ composites doped with Cr and V2O5. Science of Sintering. 2012;44(1):73–80. https://doi.org/10.2298/SOS1201073Z
7. Motlagh E.B., Nasiri H., Khaki J.V., Sabzevar M.H. Formation of metal matrix composite reinforced with nano sized Al2O3+Ni–Al intermetallics during coating of Al substrate via combustion synthesis. Surface & Coatings Technology. 2011;205(23-24):5515–5520. https://doi.org/10.1016/j.surfcoat.2011.06.026
8. Kim J.-W., Lee J.-M., Lee J.-H., Lee J.-C. Role of excess Al on the combustion reaction in the Al–TiO2–C system. Metals and Materials International. 2014;20(6): 1151–1156. https://doi.org/10.1007/s12540-014-6020-8
9. Miloserdov P.A., Gorshkov V.A., Andreev D.E., Yukhvid V.I., Miloserdova O.M., Golosova O.A. Metallothermic SHS of Al2O3–Cr2O3 + TiC ceramic composite material. Ceramics International. 2023;49(14):24071–24076. https://doi.org/10.1016/j.ceramint.2023.04.145
10. Korosteleva E.N., Knyazeva A.G., Nikolaev I.O. Phase formation in reactive sintering with reduction. Physical Mesomechanics. 2023;26(1):39–47. https://doi.org/10.1134/S1029959923010058
11. Коростелева Е.Н., Николаев И.О. Эволюция структурно-фазового состояния стальной стружки в процессе ее переработки в порошкообразный продукт. Известия вузов. Порошковая металлургия и функциональные покрытия. 2024;18(4):6–16. https://doi.org/10.17073/1997-308X-2024-4-6-16
12. Коростелева Е.Н., Николаев И.О., Барановский А.В. Синтез и эволюция структурно-фазового состояния порошковых материалов Al–Fe–Fe2O3 в условиях нагрева. В сб.: Материалы XVII Минского международного форума по тепло- и массообмену (20–24 мая 2024 г.). Минск: Институт тепло- и массообмена им. А.В. Лыкова НАН Беларуси, 2024. С. 746–748.
13. Miedema A.R., de Chȃtel P.F, de Boer F.R., de Chatel P.F. Cohesion in alloys – fundamental of a semi-empirical model. Physica B + C. 1980;100(1):1–28. https://doi.org/10.1016/0378-4363(80)90054-6
14. Binnewies M., Milke E. Thermochemical data of elements and compounds. Wiley-VCH Verlag GmbH, 2008. 928 p. https://doi.org/10.1002/9783527618347
15. Safronova V.S., Knyazeva A.G., Korosteleva E.N. A theoretical and experimental study of phase formation in Ti–CuO powder mixtures under reactive sintering conditions. New Journal of Chemistry. 2025;49(3):893–909. https://doi.org/10.1039/d4nj03751k
16. Подергин В.А. Металлотермические системы. М.: Металлургия, 1992. 272 с.
17. Корчагин М.А., Подергин В.А. Исследование химических превращений при горении конденсированных систем. Физика горения и взрыва. 1979;(3):48–53.
18. Liu W., Ismail M., Dunstan M.T., Hu W., Zhang Z., Fennell P.S., Scott S.A., Dennis J.S. Inhibiting the interaction between FeO and Al2O3 during chemical looping production of hydrogen. RSC Advances. 2015;5(3):1759–1771. https://doi.org/10.1039/C4RA11891J
19. Liu Y., Watanabe M., Okugawa M., Hagiwara T., Sato T., Seguchi Y., Adachi Y., Minamino Y., Koizumi Y. Resolving the long-standing discrepancy in Fe3Al ordering mobilities: A synergistic experimental and phase-field study. Acta Materialia. 2024;273:119958. https://doi.org/10.1016/j.actamat.2024.119958
20. Lin Y.-C., Shteinberg A.S., McGinn P.J., Mukasyan A.S. Kinetics study in Ti–Fe2O3 system by electro-thermal explosion method. International Journal of Thermal Sciences. 2014;84:369–378. https://doi.org/10.1016/j.ijthermalsci.2014.06.008
21. Mukasyan A.S., Shuck C.E. Kinetics of SHS reactions: A review. International Journal of Self-Propagating High-Temperature Synthesis. 2017;26(3):145–165. https://doi.org/10.3103/S1061386217030049
22. Durães L., Costa B.F.O., Santos R., Correia A., Campos J., Portugal A. Fe2O3/aluminum thermite reaction intermediate and final products characterization. Materials Science and Engineering: A. 2007;465(1-2):199–210. https://doi.org/10.1016/j.msea.2007.03.063
23. Bodaghi M., Zolfonoon H., Tahriri M., Karimi M. Synthesis and characterization of nanocrystalline α-Al2O3 using Al and Fe2O3 (hematite) through mechanical alloying. Solid State Sciences. 2009;11(2):496–500. https://doi.org/10.1016/j.solidstatesciences.2008.06.021
Об авторах
А. Г. КнязеваРоссия
Анна Георгиевна Князева – гл. науч. сотрудник лаборатории нелинейной механики метаматериалов и многоуровневых систем
Россия, 634055, г. Томск, пр. Академический, 8/2
Е. Н. Коростелева
Россия
Елена Николаевна Коростелева – ст. науч. сотрудник лаборатории физики консолидации порошковых материалов
Россия, 634055, г. Томск, пр. Академический, 8/2
В. С. Сафронова
Россия
Валерия Сергеевна Сафронова – лаборант-исследователь лаборатории нелинейной механики метаматериалов и многоуровневых систем
Россия, 634055, г. Томск, пр. Академический, 8/2
Рецензия
Для цитирования:
Князева А.Г., Коростелева Е.Н., Сафронова В.С. Спекание и термокинетическое моделирование эволюции состава термитных смесей в условиях регулируемого нагрева. Известия вузов. Порошковая металлургия и функциональные покрытия. 2025;19(5):5-16. https://doi.org/10.17073/1997-308X-2025-5-5-16
For citation:
Knyazeva А.G., Korosteleva Е.N., Safronova V.S. Sintering and thermokinetic modeling of the phase evolution in thermite powder mixtures under controlled heating. Powder Metallurgy аnd Functional Coatings (Izvestiya Vuzov. Poroshkovaya Metallurgiya i Funktsional'nye Pokrytiya). 2025;19(5):5-16. https://doi.org/10.17073/1997-308X-2025-5-5-16