Перейти к:
Влияние состава и шероховатости поверхности титановых сплавов на жизнедеятельность мезенхимальных стволовых клеток
https://doi.org/10.17073/1997-308X-2024-6-65-76
Аннотация
В работе исследовались сплавы на основе титана медицинского назначения: коммерческие марки ВТ1-0, ВТ6 и разрабатываемый сплав, мас. %: Ti–23Nb–5Zr. Поверхности всех образцов подвергались струйной обработке с применением 6 видов различных фракций песка, механической шлифовке и полировке методом галтовки, а также, дополнительно, электролитно-плазменной полировке (для сплава системы Ti–Nb–Zr). Исследовалось влияние метода поверхностной обработки титановых сплавов медицинского назначения и их химического состава на шероховатость, микротвердость, смачиваемость поверхности и ее взаимодействие с мезенхимальными стволовыми клетками. Микротвердость поверхности определялась по схеме «микро-Виккерс» с применением алмазного индентора при различной нагрузке. Измерения шероховатости поверхности проводились с помощью контактного профилометра. Отмечено, что электролитно-плазменная полировка повышает микротвердость и шероховатость поверхности сплава по сравнению с галтовкой. Краевой угол смачивания образцов деионизированной водой измерялся при помощи специальной установки. При этом форма капли описывалась моделью эллипса по 5 точкам. Установлено, что все созданные поверхности смачиваемы, угол смачивания возрастает с понижением шероховатости поверхности, однако струйная обработка смесями с широким разбросом частиц по размеру приводит к его повышению за счет усложнения рельефа поверхности. Для изучения биологических свойств имплантатов из сплавов ВТ6, ВТ1-0 и Ti–23Nb–5Zr после указанных видов поверхностной обработки, а также их влияния на выживаемость клеток и адгезивные характеристики материалов использовался метод прямого контакта с двумя типами мезенхимальных стволовых клеток. Разрабатываемый сплав, потенциально обладающий лучшей биомеханической совместимостью, чем коммерческие, не вызвал ухудшения поверхностных характеристик и отрицательно не повлиял на жизнедеятельность клеток.
Ключевые слова
Для цитирования:
Сударчикова М.А., Насакина Е.О., Давыдова Г.А., Валиуллин Л.Р., Морозова Я.А., Котцов С.Ю., Прокофьев П.А., Конушкин С.В., Сергиенко К.В., Севостьянов М.А., Колмаков А.Г. Влияние состава и шероховатости поверхности титановых сплавов на жизнедеятельность мезенхимальных стволовых клеток. Известия вузов. Порошковая металлургия и функциональные покрытия. 2024;18(6):65-76. https://doi.org/10.17073/1997-308X-2024-6-65-76
For citation:
Sudarchikova M.A., Nasakina E.O., Davydova G.A., Valiullin L.R., Morozova Ya.A., Kottsov S.Yu., Prokofiev P.A., Konushkin S.V., Sergienko K.V., Sevostyanov M.A., Kolmakov A.G. Influence of composition and surface roughness of titanium alloys on vital activity of mesenchymal stem cells. Powder Metallurgy аnd Functional Coatings (Izvestiya Vuzov. Poroshkovaya Metallurgiya i Funktsional'nye Pokrytiya). 2024;18(6):65-76. https://doi.org/10.17073/1997-308X-2024-6-65-76
Введение
Для изготовления имплантатов используют биоматериалы – материалы, предназначенные для контакта со средой живого организма, обеспечивая его совместимость с медицинским изделием за счет комплекса свойств, таких как сверхупругость, низкие значения модуля Юнга, высокая коррозионная стойкость и биоинертность или адгезивность [1–3]. Как правило, это металлические сплавы (титановые, кобальтовые, нержавеющие стали), полимеры, керамика. Они, однако, обладают рядом недостатков, например низкой прочностью и/или высоким модулем упругости, что в конечном итоге ведет к разрушению и окружающих тканей, и самих имплантатов [4–8]. Ограничениями при производстве титановых изделий, кроме организационных причин (например, выпуска малых партий изделий), являются сложности технологической обработки. Одной из технологических проблем титановых сплавов являются прочностные и усталостные свойства заготовок, что, однако, решается за счет разработки различных способов модифицирования структуры поверхности и подбора состава.
Низкие значения модуля Юнга и сверхупругое поведение, близкое к таковому живых тканей, демонстрируют сплавы памяти формы, особенно системы Ti–Ni [9–11]. Однако токсичные свойства никеля и вероятность коррозионного разрушения материала (повреждение изделия в среде эксплуатации) ограничивают их применимость [12–14].
В то же время современные исследования показывают, что эффекты памяти формы и сверхэластичности наблюдаются и у сплавов только из нетоксичных металлов [15–23]. Например, тантал [24] и ниобий [17; 25–27], обладая высокой коррозионной стойкостью и биосовместимостью, могут быть использованы в качестве β-стабилизаторов в титановых сплавах, способствуя уменьшению модуля упругости. Причем в работе [23] было показано, что сплав Ti–Nb–Ta имеет низкий модуль упругости и более высокую коррозионную стойкость по сравнению со сплавом Ti–6Al–4V. Цирконий обычно выступает в качестве нейтрального упрочнителя [28–31], однако, как установлено авторами [20], в β-титановых сплавах он может оказывать и β-стабилизирующее действие. Кроме того, титан и ниобий имеют близкие значения атомных радиусов (0,145–0,146 нм), тогда как у циркония он выше (0,160 нм). Следовательно, легирование титана цирконием должно способствовать увеличению межатомного расстояния в сплаве, уменьшению силы связи между атомами, а следовательно, и модуля упругости (Юнга), тогда как при легировании титана ниобием период решетки β-фазы должен по крайней мере не снижаться.
Таким образом, можно рассматривать сплавы состава Ti–Nb–Zr в качестве отличных кандидатов для использования в биомедицинских приложениях, связанных с имплантацией.
Мезенхимальные стволовые клетки (МСК) являются оптимальным объектом в качестве тест-системы для анализа биологической активности материалов, предназначенных для создания имплантатов, поскольку они обладают множественными потенциями к дифференцировке в клеточные элементы различных тканей мезенхимного происхождения [32].
Взаимодействие любого материала с клетками определяется, в том числе, качеством его поверхности, поэтому целью данной работы было исследовать взаимодействие сплава Ti–Nb–Zr после различной поверхностной обработки с мезенхимальными стволовыми клетками в сравнении с уже применяемыми в медицине материалами.
Материалы и методы
Образцы для исследования изготовлены из следующих биомедицинских материалов на основе титана:
– коммерческий материал ВТ1-0 (чистый титан), ГОСТ 19807-91;
– коммерческий сплав ВТ6 (сплав титана с алюминием и ванадием), ГОСТ 19807-91;
– разрабатываемый сплав на основе титана состава, ат. %: Ti–23Nb–5Zr.
В качестве шихтовых материалов использовали йодидный титан, ниобий марки Нб-1 и йодидный цирконий. Плавку навесок проводили в аргонодуговой плавильной печи с нерасходуемым вольфрамовым электродом. Для получения листов после выплавки слитки подвергали гомогенизирующему отжигу в вакууме, а затем теплой прокатке с применением промежуточных отжигов с последующей закалкой.
Модуль Юнга образцов листа из сплава Ti–23Nb–5Zr определяли на универсальной испытательной машине INSTRON 3382 (США) при комнатной температуре.
Взаимодействие любого материала с клетками определяется, в том числе, качеством его поверхности, поэтому было выбрано несколько вариантов ее обработки. Все образцы сплавов ВТ1-0, ВТ6 и Ti–23Nb–5Zr диаметром 20 мм и толщиной 4 мм были вырезаны на электроэрозионном станке ДК 7745 МЕ11 фирмы «Meatec» (Китай) из листов, перед пескоструйной обработкой предварительно отшлифованы шлифовальной бумагой зернистостью от 240 до 600 grit и обработаны галтовкой в галтовочной электромагнитной машине КТ-100 («CARLO de GIORGI», Италия) с абразивом из металлических игл. Также исследовали вариант с электролитно-плазменной полировкой (ЭПП) в 5 %-ном водном растворе смеси 20 % NH4F + 80 % KF поверхности сплава Ti–23Nb–5Zr при напряжении 300 В, температуре 85–88 °С в течение 10 мин. Пескоструйную обработку поверхности образцов проводили в камере объемом 90 л при давлении аргона высокой чистоты 12 атм купершлаком (размер фракций которого не превышал 0,63 мм) и песком (фракциями 0,63–1,0, 1,0–1,5 и 0,63–1,5 мм), а также их смесью (от 0,63 до 1,5 мм) в соотношении 1:1. Для полученных поверхностей определяли такие характеристики, как шероховатость и смачиваемость.
Оценку шероховатости поверхности проводили в соответствии с ГОСТ 25142-82 на профилометре Протон модели 130 (Россия). Перед измерением все образцы промывали в ультразвуковой ванне в специальном мыльном растворе, бидистиллированной воде и спирте и тщательно высушивали.
Микротвердость поверхности (HV) определяли по схеме «микро-Виккерс» по ГОСТ 9450-76 с помощью оснащенного оптическим микроскопом прибора 401/402-MVD («Wolpert Group», Германия) с применением алмазного индентора размером 10 мкм и нагрузки массой 25, 100, 300 и 500 г.
Смачиваемость образцов характеризовали краевым углом смачивания деионизированной водой, который измеряли при помощи установки Lonroy SDC-350 (Dongguan Lonroy Equipment Co., LTD, Китай) при угле наклона стойки 0°. На образец падала капля объемом 6 мкл, и спустя 60 с делался ее снимок на образце. При измерении краевого угла смачивания анализ формы капли проводят через некоторое время после касания ею анализируемой подложки. Это позволяет избавиться от различных динамических эффектов, приводящих к искажению формы упругой капли сразу после соударения с образцом. Обычно время ожидания перед анализом формы капли составляет 30–60 с после начала измерений [33–35]. При расчетах краевого угла смачивания форма капли описывалась моделью эллипса по 5 точкам.
Для изучения биологических свойств имплантатов из сплавов ВТ6, ВТ1-0 и Ti–23Nb–5Zr после указанных видов поверхностной обработки, а также влияния их образцов на выживаемость клеток и адгезивных характеристик материалов использовали метод прямого контакта с двумя типами МСК: культурой МСК из пульпы зуба человека (DPSC) (клон Th44) и иммортализованной культурой клеток фибробластов (зародышевые клетки соединительной ткани организма, участвующие в процессах регенерации и синтеза белков, наиболее важных для омоложения клеток дермы [36], МСК кожи [37]).
Для исследования на выживаемость клеток образцы были простерилизованы 70 %-ным этанолом и помещены в лунки 24-луночного планшета. Клетки DPSC на 5-м пассаже высеивали в лунки планшета в концентрации 30 тыс. кл./см2 в среде ДМЕМ/F12, содержащей 10 % FBS с добавлением 100 Ед/мл пенициллина/стрептомицина, и культивировали в течение 24 ч при температуре 37 °С в увлажненной атмосфере 5 %-ного СО2 . После окончания культивирования проводили оценку морфологии клеток на поверхности культурального пластика в прямом контакте с образцами.
В качестве отрицательного контроля в лунки вносили среду ДМЕМ/F12. По окончании культивирования проводили оценку морфологии клеток на поверхности исследуемых материалов и определяли их жизнеспособность методом флуоресцентного окрашивания клеток реагентами SYTO 9, иодидом пропидия (PI) и Hoechst 33342. Флуоресцентный краситель SYTO 9 в режиме исследования (λвозб = 450÷490 нм, λэмис = 515÷565 нм) окрашивает в зеленый цвет ДНК и РНК живых и мертвых клеток. Интеркалирующий реагент иодид пропидия при λвозб = 546 нм, λэмис = 575÷640 нм окрашивает в красный цвет ядра погибших клеток. Флуоресцентный краситель Hoechst 33342 при λвозб = 343 нм, λэмис = 483 нм окрашивает в синий цвет ДНК живых и мертвых клеток.
Влияние исследуемых материалов на клетки фибробластов изучали методом их культивирования в присутствии образцов. По истечении 24 ч с помощью инвертированного микроскопа оценивали клеточный слой по следующим параметрам: площади покрытия поверхности, форме клеток, количестве клеточных агрегатов и плавающих клеток. Подсчет клеток осуществляли в камере Горяева. Количество живых и мертвых клеток оценивали методом окраски трипановым синим реагентом (0,1 %-ный раствор) [38]. Влияние исследуемых Ti-образцов на культурально-морфологические свойства клеток определяли с учетом следующих показателей:
– коэффициента жизнеспособности – отношения живых клеток к общему их количеству, %;
– индекса пролиферации – отношения числа выросших клеток к числу засеянных [39];
– процента гибели клеток – отношения количества мертвых клеток, оставшихся после экспозиции с соединением, к общему числу клеток после экспозиции с соединением, %.
Статистическую обработку полученных данных осуществляли методом вариационной статистики с применением критерия достоверности по Стьюденту.
Выделение DPSC происходит следующим образом: после вскрытия коронки пульпу извлекали, промывали раствором Хенкса, измельчали, а затем инкубировали в 0,1 %-ном растворе коллагеназы I типа в течение 30 мин при t = 37 °C. Полученную клеточную суспензию осаждали в центрифуге с 1000 об/мин в течение 5 мин. Осадок ресуспендировали в ростовой среде DMEM/F12 с добавлением 10 % эмбриональной телячьей сыворотки (ЭТС), 100 Ед./мл пенициллина, 100 Ед./мл стрептомицина и 2 мМ глютамина и помещали в культуральные флаконы. Через 3 дня не прикрепленные к пластику клетки удаляли, а фракцию адгезивных клеток культивировали до образования 80–90 %-ного конфлюэнтного монослоя, после чего клетки помещали в суспензию с использованием смеси 0,25 %-ного раствора трипсина с раствором Версена (1:1) и рассеивали в соотношении 1:3. Пассирование клеток in-vitro осуществляли по стандартной методике в культуральных флаконах в СО2-инкубаторе (37 °С, 5 % СО2 , 80 % влажности) со сменой ростовой среды каждые 3 дня.
Результаты и их обсуждение
Модуль Юнга поверхности сплава Ti–23Nb–5Zr в исходном состоянии составлял Е = 56±5 ГПа, что значительно меньше, чем у коммерческих сплавов ВТ1-0 и ВТ6 (E > 90 ГПа) [40; 41], и близок к значениям E кости (до 30 ГПа) [42].
Было получено 6 видов образцов каждого сплава, отличающихся между собой способом струйной обработки и наличием электролитно-плазменной полировки. Результаты измерений шероховатости (Ra ) и микротвердости (HV) полученных образцов приведены в табл. 1 и 2, а микрофотографии полированных образцов (галтовка и ЭПП) – на рис. 1 (высокая неоднородность их поверхности после пескоструйной обработки не позволила получить достоверные результаты из-за скольжения индентора). Значения Ra у образцов после галтовки были ниже, чем после ЭПП. Это может объясняться тем, что в первом случае происходит своеобразное «выглаживание» рельефа поверхности, а во втором – может иметь место преимущественное травление некоторых структурных составляющих и зон ликвационной неоднородности. Корреляция между шероховатостью и микротвердостью образцов отсутствует.
Таблица 1. Результаты исследования шероховатости, микротвердости по Виккерсу
Таблица 2. Результаты исследования микротвердости полированных образцов
Рис. 1. Микрофотографии образцов с гладкой поверхностью | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
В то же время электролитно-плазменная обработка способствует повышению твердости поверхностного слоя (см. табл. 1 и 2), что, по-видимому, связано с тем, что она вызывает структурные изменения в поверхностном слое металлических материалов, и это оказывает влияние на механические свойства [43]. Причем с уменьшением нагрузки микротвердость возрастает, так как больший вклад в ее значение начинает вносить не основной объем материала, а сама поверхность (табл. 2). Зависимости шероховатости и микротвердости образцов не отмечено.
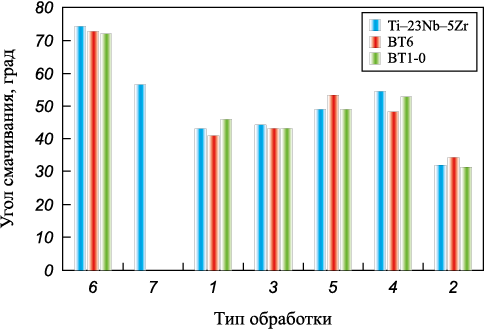
Влияние обработки на шероховатость согласуется с результатами исследования краевого угла смачивания поверхности (см. табл. 1, рис. 2). Наблюдается типичная для твердых смачиваемых жидкостью материалов закономерность, что угол смачивания тем выше (смачиваемость хуже), чем ниже шероховатость поверхности [44]. Минимальная смачиваемость поверхности наблюдается после галтовки. Однако зависимость проходит через экстремум для всех материалов после обработки смесью купершлака и исходного (не поделенного на фракции) песка. Предположительно это связано с широким разбросом размеров частиц, воздействовавших на поверхность, в результате чего среди крупных каверн, по которым оценивали шероховатость, расположено много мелких, что локально повышает угол смачиваемости. По этой же причине чуть менее, но так же выбивается из прямой закономерности угол смачиваемости в случае применения образцов, обработанных исходным песком: разброс размеров частиц меньше. Все 3 сплава показали близкие характеристики поверхности после каждой обработки.
Рис. 2. Зависимость смачиваемости от обработки поверхности (см. табл. 1) |
На рис. 3 представлен внешний вид клеток DPSC в месте контакта с исследуемыми материалами через сутки после посева. Видно, что все они не оказывают ингибирующего действия на клетки и биосовместимы1. Различий в зависимости от состава и обработки не наблюдалось.
Рис. 3. Внешний вид клеток DPSC в месте контакта с исследуемыми материалами |
Характерные микрофотографии на первые сутки культивирования для образцов после струйной обработки купершлаком и песком (1,0–1,5 мм) приведены на рис. 4 и 5 соответственно. На поверхности образцов наблюдалось большое количество «распластанных» клеток, распределенных достаточно равномерно, нежизнеспособных из них мало. Таким образом, все виды образцов оказались адгезивны для клеток.
Рис. 4. Внешний вид клеток DPSC при инкубации на поверхности образцов
Рис. 5. Внешний вид клеток DPSC при инкубации на поверхности образцов |
В табл. 3 сведены культурально-морфологические свойства клеток фибробластов, контактировавших со сплавами, в зависимости от пескоструйной обработки. Все материалы обладают низкой цитотоксичностью, что указывает на возможность их использования в медицинской практике. Выделить зависимость цитотоксических свойств сплавов от состава и метода обработки материала не удалось.
Таблица 3. Цитотоксические свойства сплавов
|
Заключение
Исследовано влияние 6 видов пескоструйной обработки и ЭПП на качество поверхности и взаимодействие с мезенхимальными стволовыми клетками двух коммерческих сплавов на основе титана, применяемых в медицине: ВТ1-0 (чистый титан) и ВТ6 (сплав титана с алюминием и ванадием), а также разрабатываемого сплава системы Ti–Nb–Zr.
Обнаружено, что ЭПП повышает микротвердость, но ухудшает шероховатость поверхности сплава по сравнению с галтовкой.
Все обработанные поверхности смачиваемы, и угол смачивания возрастает с понижением их шероховатости. Однако пескоструйная обработка смесями с широким разбросом частиц по размеру приводит к повышению угла смачивания, предположительно за счет усложнения рельефа поверхности. Наибольший угол смачивания у всех исследуемых сплавов наблюдался для поверхности после галтовки, имеющей самый «развитый» рельеф.
Все три материала обладают низкой цитотоксичностью, высокими пролиферативной активностью и жизнеспособностью. На поверхности образцов наблюдалось большое количество достаточно равномерно распределенных жизнеспособных клеток. Однозначной зависимости параметров цитотоксичности от состава и варианта обработки материала не выявлено.
Разрабатываемый сплав Ti–23Nb–5Zr, потенциально обладающий лучшей биомеханической совместимостью, чем использованные коммерческие, не показал ухудшения поверхностных характеристик и отрицательного влияния на жизнедеятельность клеток.
Список литературы
1. Park J.B., Lakes R.S. Metallic implant materials. Biomaterials. 2007;5:99–137. https://doi.org/10.1007/978-0-387-37880-0_5
2. Amirtharaj Mosas K.K., Chandrasekar A.R., Dasan A., Pakseresht A., Galusek D. Recent advancements in materials and coatings for biomedical implants. Gels. 2022;8(5):323. https://doi.org/10.3390/gels8050323
3. Pandey A., Awasthi A., Saxena K.K. Metallic implants with properties and latest production techniques: A review. Advances in Materials and Processing Technologies. 2020;6(2):405–440. https://doi.org/10.1080/2374068X.2020.1731236
4. Biesiekierski A., Wang J., Gepreel M. A.-H., Wen C. A new look at biomedical Ti-based shape memory alloys. Acta Bio-Materialia. 2012;8(5):1661–1669. https://doi.org/10.1016/j.actbio.2012.01.018
5. Zhao X., Zhang J., Song X., Guo W. Investigation on mechanical properties of laser welded joints for Ti–6Al–4V titanium alloy. Materials Science and Technology. 2013;29(12):1405–1413. https://doi.org/10.1179/1743284713Y.00000003
6. Nune K.C., Misra R., Gai X., Li S.J., Hao Y.L. Surface nanotopography-induced favorable modulation of bioactivity and osteoconductive potential of anodized 3D printed Ti–6Al–4V alloy mesh structure. Journal of Biomaterials Applications. 2018;32(8):1032–1048. https://doi.org/10.1177/0885328217748860
7. Navarro M., Michiardi A., Castaño O., Planell J.A. Biomaterials in orthopaedics. Journal of the Royal Society Interface. 2008;5(27):1137–1158. https://doi.org/10.1098/rsif.2008.0151
8. Renganathan G., Tanneru N., Madurai S. L. Orthopedical and biomedical applications of titanium and zirconium metals. Fundamental Biomaterials: Metals. 2018:211–241. https://doi.org/10.1016/B978-0-08-102205-4.00010-6
9. Alferi D., Fojt J., Kristianova E., Edwards D.W., Laasch H.-U. Influence of the manufacturing process on the corrosion and mechanical behavior of Esophageal stents. Metals. 2023;13(9):1542. https://doi.org/10.3390/met13091542
10. Elsisy M., Chun Y. Materials properties and manufacturing processes of nitinol endovascular devices. In: Bártolo, P.J., Bidanda, B. (eds) Bio-materials and prototyping applications in medicine. Springer, Cham. 2021. P. 59–79. https://doi.org/10.1007/978-3-030-35876-1_4
11. Stoeckel D., Bonsignore C., Duda S. A survey of stent designs. Minimally Invasive Therapy & Allied Technologies. 2002;11(4):137–147. https://doi.org/10.1080/136457002760273340
12. Nasakina E.O., Sudarchikova M.A., Sergienko K.V., Konushkin S.V., Sevost’yanov M.A. Ion release and surface characterization of nanostructured nitinol during long-term testing. Nanomaterials. 2019;9(11):1569. https://doi.org/10.3390/nano9111569
13. Zhang Y., Zhang Z.W., Xie Y.M., Wang S.S., Qiu Q.H., Zhou Y.L., Zeng G.H. Toxicity of nickel ions and comprehensive analysis of nickel ion-associated gene expression profiles in THP-1 cells. Molecular Medicine Reports. 2015;12(3):3273–3278. https://doi.org/10.3892/mmr.2015.3878
14. Lü X., Bao X., Huang Y., Qu Y., Lu H., Lu Z. Mechanisms of cytotoxicity of nickel ions based on gene expression profiles. Biomaterials. 2009;30(2):141–148. https://doi.org/10.1016/j.biomaterials.2008.09.011
15. Chen L.Y., Cui Y.W., Zhang L.C. Recent development in beta titanium alloys for biomedical applications. Metals. 2020;10(9):1139. https://doi.org/10.3390/met10091139
16. Dobromyslov A.V., Elkin V.A. Martensitic transformation and metastable β-phase in binary titanium alloys with d-metals of 4–6 periods. Scripta Materialia. 2001;44(6):905–910. https://doi.org/10.1016/S1359-6462(00)00694-1
17. Kim H.Y., Hashimoto S., Kim J.I., Inamura T., Hosoda H., Miyazaki S. Effect of Ta addition on shape memory behavior of Ti–22Nb alloy. Materials Science and Engineering: A. 2006;417(1-2):120–128. https://doi.org/10.1016/j.msea.2005.10.065
18. Weinmann M., Schnitter C., Stenzel M., Markhoff J., Schulze C., Bader R. Development of bio-compatible refractory Ti/Nb(/Ta) alloys for application in patient-specific orthopaedic implants. International Journal of Refractory Metals and Hard Materials. 2018;75:126–136. https://doi.org/10.1016/j.ijrmhm.2018.03.018
19. Miyazaki S., Kim H. Y., Hosoda H. Development and characterization of Ni-free Ti-base shape memory and superelastic alloys. Materials Science and Engineering: A. 2006;438–440:18–24. https://doi.org/10.1016/j.msea.2006.02.054
20. Guehennec L. Surface treatments of titanium dental implants for rapid osseointegration. Dental Materials. 2007;23(7):844–854. https://doi.org/10.4012/dmj.2012-015
21. Dubinskiy S.M., Prokoshkin S.D., Brailovski V., Inaekyan K.E., Korotitskiy A.V., Filonov M.R., Petrzhik M.I. Structure formation during thermomechanical processing of Ti-Nb-(Zr, Ta) alloys and the manifestation of the shape-memory effect. The Physics of Metals and Metallography. 2011;112(5):503–516. https://doi.org/10.1134/S0031918X11050206
22. Liu J., Chang L., Liu H., Li Y., Yang H., Ruan J. Microstructure, mechanical behavior and biocompatibility of powder metallurgy Nb–Ti–Ta alloys as biomedical material. Materials Science and Engineering: C. 2017;71:512–519. https://doi.org/10.1016/j.msec.2016.10.043
23. Hussein A.H., Gepreel M.A.H., Gouda M.K., Hefnawy A.M., Kandil S.H. Biocompatibility of new Ti–Nb–Ta base alloys. Materials Science and Engineering: C. 2016;61: 574–578. https://doi.org/10.1016/j.msec.2015.12.071
24. Zhou Y.L., Niinomi M., Akahori T. Effects of Ta content on Young’s modulus and tensile properties of binary Ti–Ta alloys for biomedical applications. Materials Science and Engineering: A. 2004;371(1-2):283–290. https://doi.org/10.1016/j.msea.2003.12.011
25. Cheng X., Liu S., Chen C., Chen W., Liu M., Li R., Zhang X., Zhou K. Microstructure and mechanical properties of additive manufactured porous Ti–33Nb–4Sn scaffolds for orthopaedic applications. Journal of Materials Science: Materials in Medicine. 2019;30:1–12. https://doi.org/10.1007/s10856-019-6292-0
26. Li Y.H., Shang X.Y. Recent progress in porous TiNb-based alloys for biomedical implant applications. Materials Science and Technology. 2020;36(4):385–392. https://doi.org/10.1080/02670836.2020.1724415
27. Zhao D., Chang K., Ebel T., Qian M., Willumeit R., Yan M., Pyczak F. Microstructure and mechanical behavior of metal injection molded Ti–Nb binary alloys as biomedical material. Journal of the Mechanical Behavior of Biomedical Materials. 2013;28:171–182. https://doi.org/10.1016/j.jmbbm.2013.08.013
28. Munir K., Lin J., Wright P. F., Ozan S., Li Y., Wen C. Mechanical, corrosion, nanotribological, and biocompatibility properties of equal channel angular pressed Ti–28Nb–35.4 Zr alloys for biomedical applications. Acta Biomaterialia. 2022;149:387–398. https://doi.org/10.1016/j.actbio.2022.07.005
29. Li S., Choi M., Nam T. Effect of thermo-mechanical treatment on microstructural evolution and mechanical properties of a superelastic Ti–Zr-based shape memory alloy. Materials Science and Engineering: A. 2020;789:139664. https://doi.org/10.1016/j.msea.2020.139664
30. Hussein M. A., Kumar M., Drew R., Al-Aqeeli N. Electrochemical corrosion and in vitro bioactivity of nano-grained biomedical Ti–20Nb–13Zr alloy in a simulated body fluid. Materials. 2017;11(1):26. https://doi.org/10.3390/ma11010026
31. Kim J. I., Kim H. Y., Inamura T., Hosoda H., Miyazaki S. Shape memory characteristics of Ti–22Nb–(2–8) Zr (at.%) biomedical alloys. Materials Science and Engineering: A. 2005;403(1-2):334–339. https://doi.org/10.1016/j.msea.2005.05.050
32. Лыков А.П. Мезенхимные стволовые клетки: свойства и клиническое применение. Сибирский научный медицинский журнал. 2023;43(2):40–53. https://doi.org/10.18699/SSMJ20230204
33. Lanning B.R. Method for predicting wettability and interfacial bond strengths at metal/ceramic interfaces. Mines Theses & Dissertations. Ann Arbor: ProQuest LLC, 1990. 180 p.
34. Hebbar R.S., Isloor A.M., Ismail A.F. Chapter 12 – Contact angle measurements. In: Membrane characterization. Massachusetts: Elsevier Inc., 2019. P. 219–255. https://doi.org/10.1016/B978-0-444-63776-5.00012-7
35. Decker E.L., Frank B., Suo Y., Garoff S. Physics of contact angle measurement. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 1999;156(1-3): 177–189. https://doi.org/10.1016/S0927-7757(99)00069-2
36. Шурыгина И.А., Шурыгин М.Г., Аюшинова Н.И., Каня О.В. Фибробласты и их роль в развитии соединительной ткани. Байкальский медицинский журнал. 2012;110(3):8–12.
37. Павлова С.В., Сергеевичев Д.С., Чепелева Е.В., Козырева В.С., Малахова А.А., Захарова И.С., Закиян С.М. Сравнение мезенхимальных стромальных клеток костного мозга и региональных стволовых клеток сердца и фибробластов кожи человека. Патология кровообращения и кардиохирургия. 2015;19(S4-2):12–19.
38. Nabatov A.A., Raginov I.S. The DC-SIGN-CD56 interaction inhibits the anti-dendritic cell cytotoxicity of CD56 expressing cells. Infectious Agents and Cancer. 2015(10):1–11. https://doi.org/10.1186/s13027-015-0043-8
39. Дьяконов Л.П., Акиншина Г.Т., Билько Н.М., Гальнбек Т.В. Животная клетка в культуре. Изд. 2-е доп. М.: Компания Спутник, 2009. 652 с.
40. Лутфуллин Р.Я., Трофимова Е.А. Нормальный модуль упругости титанового сплава ВТ6С и его чувствительность к изменению структуры. Письма о материалах. 2017;7(1):12–16. https://doi.org/10.22226/2410-3535-2017-1-12-16
41. ГОСТ Р 8.982-2019. Титановые сплавы марки ВТ. Скорость звука, относительное температурное расширение, плотность и модуль Юнга в диапазоне температур от 20 °С до 800 °С. М.: Стандартинформ, 2019. 20 c.
42. Wu D., Isaksson P., Ferguson S.J., Persson C. Young’s modulus of trabecular bone at the tissue level: A review. Acta Biomaterialia. 2018;78:1–12. https://doi.org/10.1016/j.actbio.2018.08.001
43. Терентьев В.Ф., Слизов А.К., Смыслов А.М., Тамидаров Д.Р., Просвирнин Д.В., Пенкин А.Г., Ширяев Л.П., Сиротинкин В.П. Влияние электролитно-плазменной полировки на механические свойства аустенитно-мартенситной трип-стали ВНС9-Ш. Деформация и разрушение материалов. 2020;2:21–28.
44. Гродский А.С., Киенская К.И., Гаврилова Н.Н., Назаров В.В. Основные понятия и уравнения коллоидной химии. М.: РХТУ им. Д.И. Менделеева, 2013. 40 с.
Об авторах
М. А. СударчиковаРоссия
Мария Андреевна Сударчикова – мл. науч. сотрудник лаборатории прочности и пластичности металлических и композиционных материалов и наноматериалов
Россия, 119334, г. Москва, Ленинский пр-т, 49
Е. О. Насакина
Россия
Елена Олеговна Насакина – к.т.н., ст. науч. сотрудник лаборатории прочности и пластичности металлических и композиционных материалов и наноматериалов
Россия, 119334, г. Москва, Ленинский пр-т, 49
Г. А. Давыдова
Россия
Галина Анатольевна Давыдова – к.ф.-м.н., вед. науч. сотрудник лаборатории роста клеток и тканей
Россия, 142290, Московская обл., г. Пущино, ул. Институтская, 3
Л. Р. Валиуллин
Россия
Ленар Рашитович Валиуллин – к.б.н., заведующий лабораторией пробиотических препаратов и ферментов
Россия, 420075, Республика Татарстан, г. Казань, г-к Научный, 2
Я. А. Морозова
Россия
Ярослава Анатольевна Морозова – инженер-исследователь лаборатории прочности и пластичности металлических и композиционных материалов и наноматериалов
Россия, 119334, г. Москва, Ленинский пр-т, 49
С. Ю. Котцов
Россия
Сергей Юрьевич Котцов – мл. науч. сотрудник лаборатории синтеза функциональных материалов и переработки минерального сырья
Россия, 119071, г. Москва, Ленинский пр-т, 31
П. А. Прокофьев
Россия
Павел Александрович Прокофьев – к.т.н., мл. науч. сотрудник лаборатории физикохимии тугоплавких и редких металлов и сплавов
Россия, 119334, г. Москва, Ленинский пр-т, 49
С. В. Конушкин
Россия
Сергей Викторович Конушкин – к.т.н., науч. сотрудник лаборатории прочности и пластичности металлических и композиционных материалов и наноматериалов
Россия, 119334, г. Москва, Ленинский пр-т, 49
К. В. Сергиенко
Россия
Константин Владимирович Сергиенко – мл. науч. сотрудник лаборатории прочности и пластичности металлических и композиционных материалов и наноматериалов
Россия, 119334, г. Москва, Ленинский пр-т, 49
М. А. Севостьянов
Россия
Михаил Анатольевич Севостьянов – к.т.н., вед. науч. сотрудник лаборатории прочности и пластичности металлических и композиционных материалов и наноматериалов
Россия, 119334, г. Москва, Ленинский пр-т, 49
А. Г. Колмаков
Россия
Алексей Георгиевич Колмаков – д.т.н., чл.-корр. РАН, зав. лабораторией прочности и пластичности металлических и композиционных материалов и наноматериалов
Россия, 119334, г. Москва, Ленинский пр-т, 49
Рецензия
Для цитирования:
Сударчикова М.А., Насакина Е.О., Давыдова Г.А., Валиуллин Л.Р., Морозова Я.А., Котцов С.Ю., Прокофьев П.А., Конушкин С.В., Сергиенко К.В., Севостьянов М.А., Колмаков А.Г. Влияние состава и шероховатости поверхности титановых сплавов на жизнедеятельность мезенхимальных стволовых клеток. Известия вузов. Порошковая металлургия и функциональные покрытия. 2024;18(6):65-76. https://doi.org/10.17073/1997-308X-2024-6-65-76
For citation:
Sudarchikova M.A., Nasakina E.O., Davydova G.A., Valiullin L.R., Morozova Ya.A., Kottsov S.Yu., Prokofiev P.A., Konushkin S.V., Sergienko K.V., Sevostyanov M.A., Kolmakov A.G. Influence of composition and surface roughness of titanium alloys on vital activity of mesenchymal stem cells. Powder Metallurgy аnd Functional Coatings (Izvestiya Vuzov. Poroshkovaya Metallurgiya i Funktsional'nye Pokrytiya). 2024;18(6):65-76. https://doi.org/10.17073/1997-308X-2024-6-65-76
JATS XML